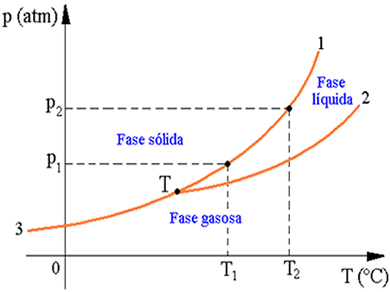
A fase na qual uma substância se apresenta depende de suas condições de pressão e temperatura. Desta forma, para cada substância dizemos que há pares de valores dessas duas variáveis que correspondem à fase sólida, pares que correspondem à fase líquida e par que corresponde à fase gasosa.
Caso os possíveis pares de valores sejam lançados em um diagrama cartesiano, no qual se coloca em ordenadas a pressão e em abscissas a temperatura, obteremos, para um dado volume da amostra da substância, o diagrama de fases da substância. Em um diagrama de fases temos as seguintes transições:
1 – curva de fusão: limita as regiões das fases sólida e líquida.
2 – curva de vaporização: limita as regiões das fases líquida e gasosa.
3 – curva de sublimação: limita as regiões das fases sólida e gasosa.
2 – curva de vaporização: limita as regiões das fases líquida e gasosa.
3 – curva de sublimação: limita as regiões das fases sólida e gasosa.
Nenhum comentário:
Postar um comentário